DETALLE DE LAS ACTIVIDADES REALIZADAS EN EL TRIMESTRE
Planificación de Clases I trimestre
SEMANA 1
Acuerdos y criterios de evaluación- trimestre Clic aquí
Prueba diagnóstica
Prueba icfes clic aquí
SEMANA 2
PRESENTACION DE CLASE CLIC AQUI
SEMANA 3
Teniendo en cuenta lo aprendido, desarrolla los siguientes puntos.
1. En el laboratorio se hace reaccionar aluminio y oxigeno para producir oxido aluminio. En este procedimiento se emplean 516 moles de aluminio, y se quiere conocer la cantidad de moles que son producidos.
2. determine la cantidad de moles de hidrógeno necesarios para producir 125 moles de agua.
3. determine la masa en moles de oxido sulfúrico necesaria para producir 213 moles de ácido sulfúrico
SEMANA 6
balancear las siguientes ecuaciones químicas, asigne los coeficientes estequiométricos con color rojo.
SEMANA 7
tarea guía clic aquí
PRESENTACIÓN ICFES 2 CLIC AQUÍ
PRESENTACIÓN ICFES 1 CUADERNILLO CLIC AQUI
SEMANA 9
SEMANA 10
Examen final trimestral
SEMANA 11
Introducción a las soluciones
Presentación de clase clic aquí
SEMANA 1y 2
- Acuerdos de clase y desempeños de clase
- preguntas prueba saber 1
- PREGUNTAS PRUEBA SABER 2
- Discusión preguntas prueba saber
SEMANA 3
TALLER N°1 LOS GASES CLIC AQUÍ
ANÁLISIS DE GRÁFICAS
SEMANA 4
- QUÍMICA: TALLER BALANCE DE ECUACIONES
- vídeo estequiometria
SEMANA 5
- QUÍMICA: Taller reactivo limitante y rendimiento de reacción
SEMANA 6
- BIOLOGÍA: REPRODUCCIÓN CELULAR
- QUÍMICA: REACTIVO LIMITANTE Y EN EXCESO
PORCENTAJE DE RENDIMIENTO DE REACCIÓN
SEMANA7
- BIOLOGIA: introducción a la bioquímica- ciclo de krebs
- Química: quiz estequiometria
SEMANA 8 ( 25 al 25 de marzo)
Química: realizaremos repaso del atomo, estructura atomica, iones y distribución electronica. Para ello desarrollamos en clase taller complementario.
- Química: taller el átomo repaso
SEMANA 9
- Quimica: numero de oxidación
( 28 de marzo al 1 de abril)
Química: lunes 28 se realizo el repaso de estados de oxidación, iones, cationes y aniones e introducción a los óxidos, hidróxidos y ácidos, viernes 1 no hubo clase
SEMANA 10
Semana 10 ( 4 al 8 de abril)
Química: lunes 4 de abril realizaremos repaso de nomenclatura- cationes ,aniones para formación de sales, hidróxidos, ácidos y óxidos. viernes 8 de abril no tendremos clase por inauguración de los juegos.
SEMANA 11
Quimica: se realiza la explicación de las 3 nomenclaturas para oxidos: stock, sistematica y tradicional.
Se revisa el taller de clase "el atomo" con los 5 ejercicios planteados.
viernes 22 de abril trabajo de literatura profesor angel aguirre.
SEMANA 12
(25 al 29 de abril)
Química: lunes 18 de abril realizaremos repaso de nomenclatura- Hidroxidos. Biología: para el viernes 29 tarea: realizar el taller de nomenclatura 6 puntos de los mencionados en la clase.
Química: Taller de nomenclatura inorganica
SEMANA 13
plan de mejoramiento
Química: explicación nomenclatura de ácidos, taller nomenclatura, desarrollo puntos 4,5,7
II TRIMESTRE
Química: explicación nomenclatura de sales, entrega del taller nomenclatura inorgánica.
SEMANA 2
Biología:
Prueba saber 2 preguntas.
Química: nomenclatura inorganica. refuerzo.
SEMANA 3
Biología:
SEMANA 4
explicación de ciclo de krebbs y de mitosis y meiosis.
SEMANA 5
Química: Juego por equipos carta-Quím
SEMANA 6
Biología: preguntas prueba saber.
Química: juego cartaquim- quiz nomenclatura química inorganica.
SEMANA 7
EL CARBONO
química del carbono
SEMANA 8
Química: taller introducción a la quimica del carbono |
SEMANA 9
explicación de los alcanos, estructura e isomeria.
SEMANA 10
explicación Alcanos, estructura y nomenclatura.
SEMANA 11
Explicación Alcanos, estructura y nomenclatura.
SEMANA 12
PESTAÑINA, LABIAL Y BETUN CERAS PARA SU FABRICACION
NOMENCLATURA ORGÁNICA
ALCOHOLES (R - OH)
Un alcohol es un compuesto que contiene uno o más grupos hidroxilos (-OH) enlazados a un radical carbonado R. Los alcoholes que contienen sólo un grupo -OH se nombran añadiendo la terminación -ol al nombre del hidrocarburo correspondiente del cual deriva. Para ello el primer paso es elegir como cadena principal la cadena más larga que contiene al grupo -OH, de forma que se le asigne el localizador más bajo posible. Si hay más de un grupo -OH se utilizan los términos -diol, -triol, etc, según el número de grupos hidroxilo presentes, eligiéndose como cadena principal, la cadena más larga que contenga el mayor número de grupos -OH, de forma que se le asignen los localizadores más bajos.
Cuando el grupo -OH se encuentra unido a un anillo aromático (benceno) el compuesto recibe el nombre de fenol. Cuando el grupo -OH va como sustituyente se utiliza el prefijo hidroxi-.

ÉTERES (R - O - R´)
Podemos considerar los éteres como derivados de los alcoholes en los que el hidrógeno del grupo -OH es reemplazado por un radical R´. Para nombrar los éteres se nombra la cadena más sencilla unida al oxígeno (RO-) terminada en -oxi (grupo alcoxi) seguido del nombre del hidrocarburo que corresponde al otro grupo sustituyente. También se pueden nombrar indicando los nombres de los radicales R y R´ seguidos de la palabra éter.

ALDEHÍDOS (R -CHO)
En los aldehídos, el grupo carbonilo (C=O) se encuentra unido a un radical R y a un hidrógeno. El grupo -CHO es un grupo terminal, es decir, siempre se encontrará en un extremo de la cadena y por lo tanto se le asigna el número localizador más bajo. Para nombrar un aldehído se elige como cadena principal la cadena más larga que contenga al grupo -CHO. Si se encuentra alguna instauración (doble o triple enlace) se elegirá como cadena principal la que contenga al grupo -CHO y la citada instauración. El nombre del compuesto se obtiene añadiendo al nombre del compuesto que constituye la estructura principal la terminación -al.
Si existen dos grupos -CHO se elegirá como cadena principal la que contiene a dichos grupos y se nombran de igual manera que en el caso anterior finalizando con el sufijo -dial y si además hay presentes instauraciones se les debe asignar los localizadores más bajos. Cuando el grupo -CHO, siendo el grupo principal, se encuentra unido a un sistema cíclico el nombre se formará indicando el sistema cíclico seguido de la terminación -carbaldehído.
Cuando el grupo -CHO no es grupo principal entonces se nombra con el prefijo -formil.

CETONAS (R - CO - R´)
En las cetonas el grupo principal es también el grupo carbonilo (C=O), pero a diferencia de los aldehídos no es un grupo terminal por lo que para nombrar estos compuestos se elige la cadena más larga que contenga a dicho grupo y se le asignará el localizador más bajo posible. El nombre del compuesto se obtiene añadiendo la terminación -ona al nombre del compuesto que constituye la estructura principal.
Cuando el grupo carbonilo se encuentra como grupo sustituyente en una cadena y no es el grupo principal, entonces se nombra con el prefijo -oxo.
Nombre | Fórmula |
2-Hexanona (Hexan-2-ona) |  |
2,4-Pentanodiona (Pentano-2,4-diona) |  |
Butanona |  |
3-Heptin-2,6-diona (Hept-3-in-2,6-diona) |  |
2-Oxopentanal |  |
ÁCIDOS CARBOXÍLICOS (R - COOH)
Para nombrar los ácidos carboxílicos se elige como cadena principal la cadena hidrocarbonada más larga que contenga al grupo principal el cual recibirá el localizador más bajo (el grupo carboxilo se encuentra siempre en una posición terminal). Se antepone la palabra ácido seguido de los sustituyentes con sus localizadores por orden alfabético, nombre de la cadena carbonada y terminación en -oico. Si hay alguna instauración (doble o triple enlace) la cadena principal sería la que contiene el grupo -COOH y la instauración.
Nombre | Fórmula |
2-Hexanona (Hexan-2-ona) |  |
2,4-Pentanodiona (Pentano-2,4-diona) |  |
Butanona |  |
3-Heptin-2,6-diona (Hept-3-in-2,6-diona) |  |
2-Oxopentanal |  |
ÉSTERES (R - COO - R´)
Los ésteres se pueden nombrar a partir del ácido del cual derivan, eliminando la palabra ácido, cambiando la terminación -oico por -oato y seguida del nombre del radical que sustituye al H del grupo -OH del ácido.
Cuando este grupo no es el principal se utiliza el prefijo oxicarbonil-.
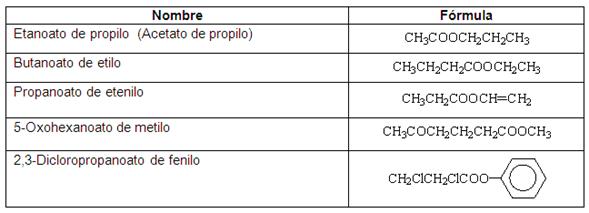
SALES (R - COOM)
Las sales orgánicas se nombran como el ácido del cual derivan, eliminando la palabra ácido, cambiando la terminación -oico por -oato y seguida del nombre del metal que sustituye al H del grupo -OH del ácido.
Ejemplos:

Funciones nitrogenadas
Las funciones nitrogenadas son las que contienen, además de átomos de carbono y de hidrógeno, átomos de nitrógeno, aunque también pueden contener átomos de oxígeno. Se clasifican en:
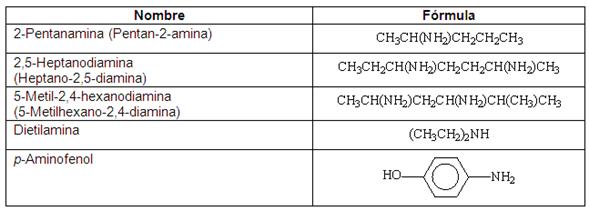
1. AMINAS (R - NH2)
Las aminas pueden ser primarias, secundarias y terciarias según presenten uno, dos o tres radicales R unidos al átomo de nitrógeno. Para nombrar las aminas primarias (R - NH2) se puede proceder de dos formas. Una consiste en considerar el grupo R como un alcano al cual se le añade la terminación - amina. En este caso hay que buscar para el grupo -NH2 el localizador más bajo posible. La segunda forma consiste en considerar el grupo -NH2 como la estructura fundamental y se nombra el grupo R como un radical al que se le añade el sufijo -amina.
Para nombrar las aminas secundarias (R1 - NH - R2) y terciarias (R1 - NR2R3) se toma como estructura principal aquella que contenga un radical Rcon mayor prioridad de acuerdo con los criterios de selección de cadena principal ya vistos y para indicar que los otros radicales se unen al nitrógeno se utiliza la letra N seguido del nombre del radical correspondiente.
También se pueden nombrar las aminas secundarias y terciarias indicando los nombres de todos los radicales sustituyentes seguidos del sufijo -amina.
Cuando el grupo -NH2 va como sustituyente se utiliza el prefijo amino-.
Ejemplos:
AMIDAS (R- CO - NH2)
Las amidas primarias se nombran a partir del ácido correspondiente eliminando la palabra ácido y cambiando la terminación -oico por -amida. Se trata de un grupo terminal. Si el grupo -CONH2 se encuentra unido a un anillo, siendo grupo principal, entonces se nombra como -carboxamida.
Si las amidas son secundarias (R - CO - NH - R´) o terciarias (R - CO - NR´R´´) los sustituyentes que reemplazan a los hidrógenos se localizan empleando las letras N.
Cuando existen otros grupos funcionales de mayor prioridad se nombra con el prefijo carbamoil-.
Ejemplos:

NITRILOS (R - C=N)
El grupo -CN es terminal, por lo que debe ir en el extremo de la cadena. Para nombrar los nitrilos se añade el sufijo -nitrilo al nombre del hidrocarburo correspondiente a la cadena carbonada. En el caso de que haya más de un grupo -CN o bien se encuentre unido a un anillo, se suele emplear el sufijo -carbonitrilo.
Cuando existen otros grupos funcionales de mayor prioridad el grupo -CN se nombran con el prefijo ciano-.
Ejemplos:


JABÓN CASERO
EXPERIMENTOS CIENTIFICOS
pagina para elaborar jabón empresa
como hacer labial y sombras
pagina para labial
HIBRIDACION DEL CARBONO
******************************************************************************
1. REACCIONES ORGÁNICAS
Estas reacciones en general son muy lentas. -Se obtienen rendimientos bajos. -Hay ciertos aspectos fundamentales que se deben conocer para estudiar una reacción orgánica:
a) La naturaleza del sustrato (o sustancia orgánica que reacciona)
b) El tipo de reactivo (o sustancia que ataca a la molécula orgánica). Se clasifican en dos grandes grupos:
- Reactivos nucleófilos (buscadores de núcleos positivos)
- Reactivos electrófilos (buscadores de electrones)
2. EFECTOS ELECTRÓNICOS -Son los factores que influyen en la distribución de los electrones en la molécula orgánica y en su posible desplazamiento. -Estos efectos pueden ser:
- Efecto inductivo: Desplazamiento permanente del par de electrones de un enlace sencillo, cara el átomo más electronegativo de los que forman en enlace.
- Efecto mesómero o de resonancia: Desplazamiento permanente de los electrones que forman un enlace π cara a uno de los átomos enlazados.
- Efecto inductómero y electrómero: Desplazamientos electrónicos temporales que se producen en una molécula orgánica al acercarse el reactivo.
- Ruptura hemolítica o homopolar: El enlace se rompe de manera que cada uno de los átomos que lo forman queda con un electrón del par de enlace. Las dos especies formadas reciben el nombre de radicales libres y por tener un electrón desapareado son muy reactivas.
- Ruptura heterolítica o heteropolar: Uno de los átomos queda con el par de electrones del enlace y el otro con un orbital vacío, es decir, se forma un ión negativo y otro positivo. o Ión carbonio o carbocatión (C+ ): gran tendencia a captar electrones. o Carbanión (C- ): suele ser muy inestable y menos frecuente.
Hay gran variedad de sustancias orgánicas, por tanto es lógico que haya muchas formas de reaccionar para estas sustancias.
- Reacciones de sustitución: -Son aquellas en las que un átomo o grupo atómico se sustituye por otro átomo o grupo diferente. -Los principales tipos de sustitución son: o Sustitución radicálica: transcurre a través de radicales libres. Cuando el enlace es apolar y sigue 3 etapas: iniciación, propagación y finalización. o Sustitución nucleofílica (SN): un reactivo nucleófilo sustituye a un grupo electronegativo unido a un C saturado. Puede ocurrir según dos mecanismos diferentes:
• SN2: la ruptura y formación de nuevos enlaces es simultánea, formación de un complejo activado muy inestable. o Sustitución electrófila (SE): el reactivo atacante es un electrófilo que ataca en zonas de alta densidad electrónica.
- Reacciones de sustitución: -Son en las que se rompe un enlace múltiple y se forman enlaces sencillos con átomos o grupos de átomos que se añaden a la molécula. -Pueden clasificarse en:
* Adición nucleófila: cuando el sustrato tiene enlaces múltiples polarizados.
- Reacciones de eliminación: -Pueden considerarse reacciones inversas a las de adición. -En ellas, el ataque de una base de Lewis produce la eliminación de dos átomos o grupos de átomos del sustrato, sin que se incorporen otras especies químicas. -Transcurren mediante dos mecanismos distintos:
* E2: la reacción ocurre en una sola etapa.
- Otros tipos de reacciones:
b. Reacciones de esterificación: Reacciones entre ácidos carboxílicos y alcoholes para producir un éster, en presencia de un catalizador ácido.
c. Reacciones de combustión: Reacciones de los compuestos orgánicos con oxígeno para producir dióxido de carbono, agua y otros productos. La mayoría de los compuestos orgánicos arden en presencia de oxígeno atmosférico.
d. Reacciones de condensación: Reacción de adición seguida de otra de eliminación.
****************************************************************************
CADENA ALIMENTARIAVIDEO DE APOYO BALANCEO POR REDOX
VÍDEO APOYO CÁLCULOS ESTEQUIOMTRICOS
PRUEBA EXAMEN FINAL i trimestre
************************
















No hay comentarios:
Publicar un comentario